人类衰老的主要机制是什么?
抗衰是从古至今一个经久不衰的话题。
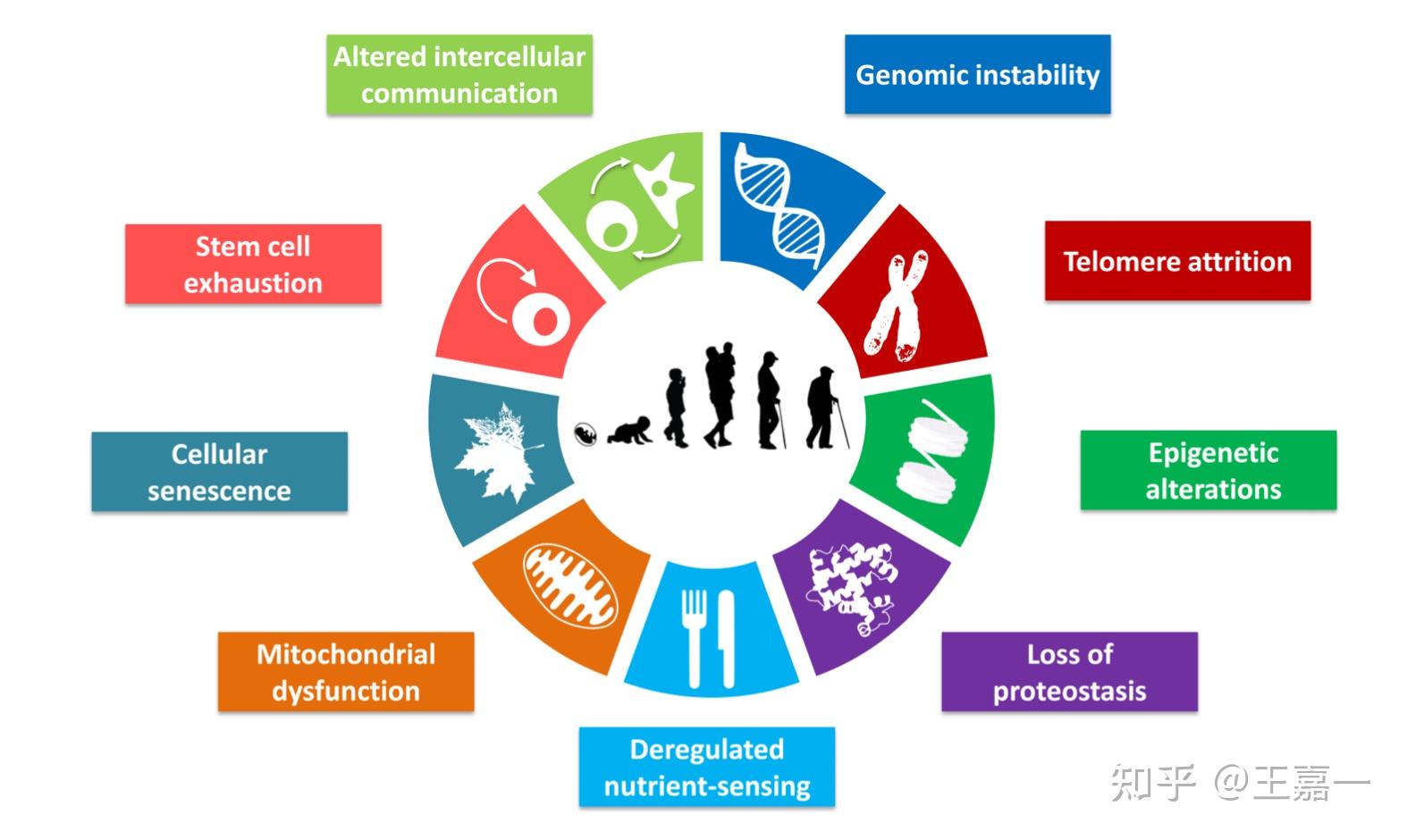
‘The Hallmarks of Aging ’这篇综述列举了九个代表不同生物体衰老共同标志,特别强调哺乳动物的衰老。
这些标志是:基因组不稳定性、端粒磨损/损耗、表观遗传改变、蛋白质稳态丧失、营养感应失调、线粒体功能障碍、细胞衰老、干细胞衰竭和细胞间通讯改变。
剖析各标志之间的相互联系及其对衰老的相对贡献,确定药物靶点,以在衰老过程中改善人类健康,并将副作用降至最低是人们研究的方向和目标。
上述的标志在不同程度上满足了:(i)在正常老化过程中表现出来; (ii) 其实验性加重会加速老化; (iii) 其实验性改进应延缓正常衰老过程,从而延长健康寿命。
1. 基因组不稳定性
衰老的一个共同点是基因损伤在整个生命中的积累。此外,许多过早衰老疾病,例如 Werner 综合征和 Bloom 综合征,是 DNA 损伤积累增加的结果。
DNA 的完整性和稳定性不断受到外源性物理、化学和生物制剂的挑战,以及内源性威胁(如下图),为了最大限度地减少这些损伤,生物体已经进化出一个复杂的 DNA 修复机制网络,这些机制能够处理对核 DNA 造成的大部分损伤。
但是,过度的损伤,会引起修复跟不上,从而引起衰老。
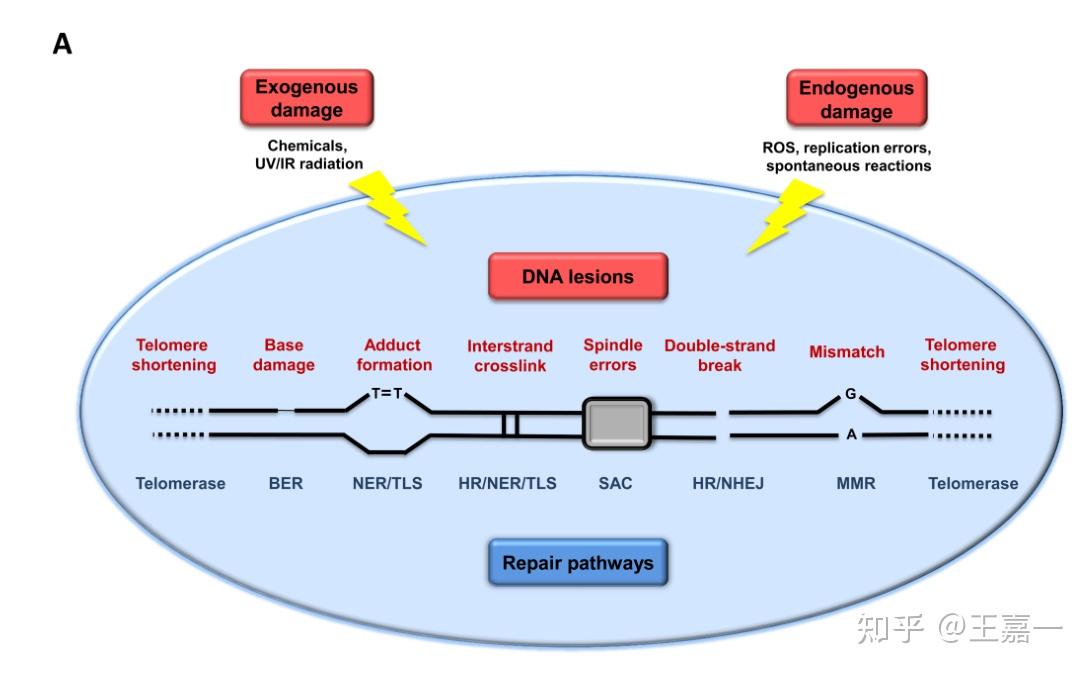
基因组稳定系统包含三个方面:核 DNA、线粒体DNA、核结构。
(1)核 DNA
研究人员在老年人基一些生物模型中发现了突变细胞的积聚;同时还发现其他形式的DNA损伤,例如,染色体非整倍数,和拷贝数变化等。所有这些都会影响关键基因及其转录途径,从而产生功能失调的细胞。
如果这些细胞不能因细胞凋亡或衰老而消除,可能会危害组织的有机体稳态。
当DNA损伤影响干细胞的功能能力时,这尤其重要,从而损害了它们在组织更新中的作用。
通过实验,研究人员发现 人工增强核DNA修复机制可能会延迟衰老。
(2)线粒体DNA
衰老线粒体DNA的突变和缺失可能促进衰老的发生。
线粒体DNA一直被认为是衰老相关体细胞突变的主要目标,原因是线粒体的氧化微环境。线粒体DNA中缺乏保护性组蛋白,以及与核DNA相比,线粒体DNA修复机制的效率有限。
确定减少线粒体DNA突变负荷的操作是否能够延长寿命,是未来值得研究的一个方向。
(3)核结构
除了核或线粒体DNA的基因组损伤,核纤层的缺失/缺陷也会导致基因组不稳定。
核纤层蛋白构成核层的主要组成部分,通过为连接染色质和调节基因组稳定性的蛋白质复合体提供支架而参与基因组维护
核层异常与早衰的因果关系已在小鼠实验中得到证实,此外,已经开发了一种基于同源重组的策略来纠正来自HGP患者的诱导多能干细胞(IPSCs)中的LMNA突变,为未来的细胞治疗开辟了一条道路。
2. 端粒磨损/损耗
哺乳动物的正常衰老伴随着端粒的磨损。
此外,病理性端粒功能障碍会加速小鼠和人类的衰老,而实验性的端粒酶刺激可以延缓小鼠的衰老。
3. 表观遗传改变
各种表观遗传改变会影响整个生命过程中的所有细胞和组织。
表观遗传变化涉及 DNA 甲基化模式的改变、组蛋白的翻译后修饰和染色质重塑。
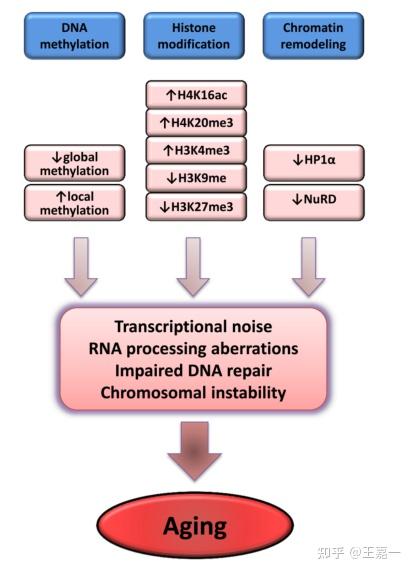
有多种证据表明衰老伴随着表观遗传变化,并且表观遗传扰动可在模式生物中引发早衰综合征。此外,SIRT6 举例说明了一种表观遗传相关酶,其功能丧失会降低小鼠的寿命,而其功能获得会延长小鼠的寿命。总的来说,这些y研究表明操纵表观基因组有望改善与年龄相关的疾病并延长健康寿命。
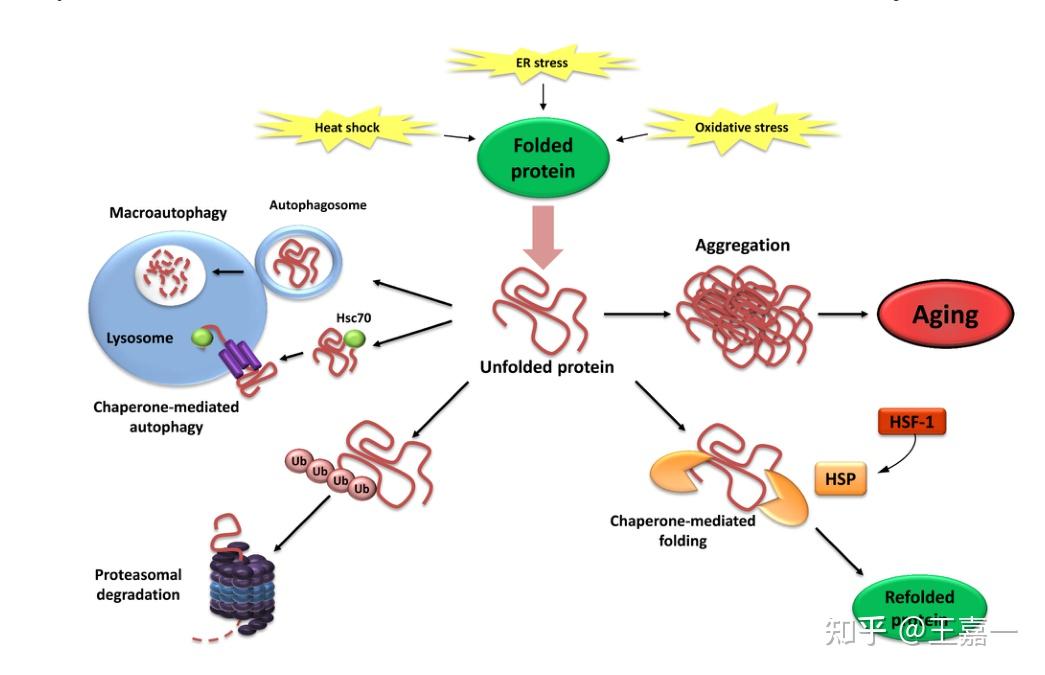
4. 蛋白质稳态丧失
有证据表明,衰老与受扰动的蛋白质稳态有关,蛋白质稳态扰动实验可诱发与年龄相关的病理。还有一些很有希望的基因操作例子可以改善哺乳动物的蛋白质稳态和延缓衰老。
5. 营养感应失调
哺乳动物的生长激素轴包括由垂体前叶产生的生长激素 (GH) 及其次级介质胰岛素样生长因子 (IGF-1),
它由许多细胞类型,最显着的是肝细胞产生,以响应 GH。
IGF-1 的细胞内信号通路与胰岛素引发的信号通路相同,它通知细胞葡萄糖的存在。因此,IGF-1 和胰岛素信号传导被称为“胰岛素和 IGF-1 信号传导”(IIS)通路。
值得注意的是,IIS 途径是进化中最保守的衰老控制途径,其多个靶点包括转录因子 FOXO 家族和 mTOR 复合物,它们也参与衰老并在进化过程中得到保护。
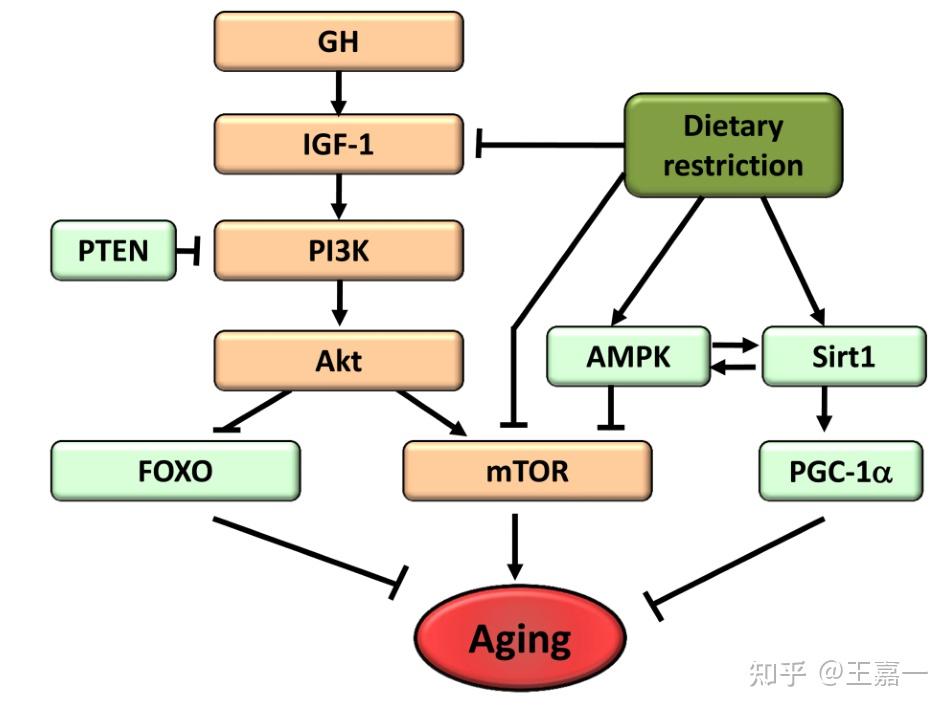
总而言之,目前可用的证据有力地支持了这样的观点,即合成代谢信号加速衰老,减少营养信号延长寿命。更重要的是,一种模仿有限营养供应状态的药物操作,如雷帕霉素,可以延长小鼠的寿命。
6. 粒体功能障碍
随着细胞和生物体的老化,呼吸链的效力趋于减弱,从而增加电子泄漏并减少三磷酸腺苷的生成。
线粒体功能障碍与衰老之间的关系长期以来一直受到怀疑,但剖析其细节仍然是衰老研究的主要挑战。
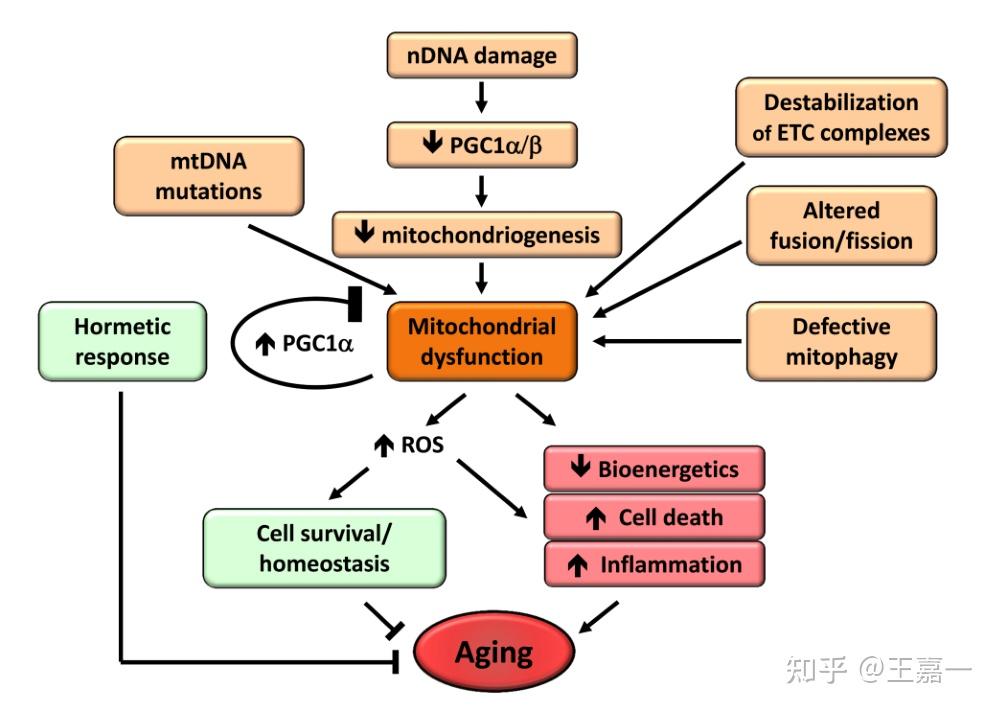
线粒体功能对衰老过程有着深远的影响。线粒体功能障碍可以加速哺乳动物的衰老。尽管已经存在一些证据,但仍不太清楚,改善线粒体功能,例如通过刺激有丝分裂,是否可以延长哺乳动物的寿命。
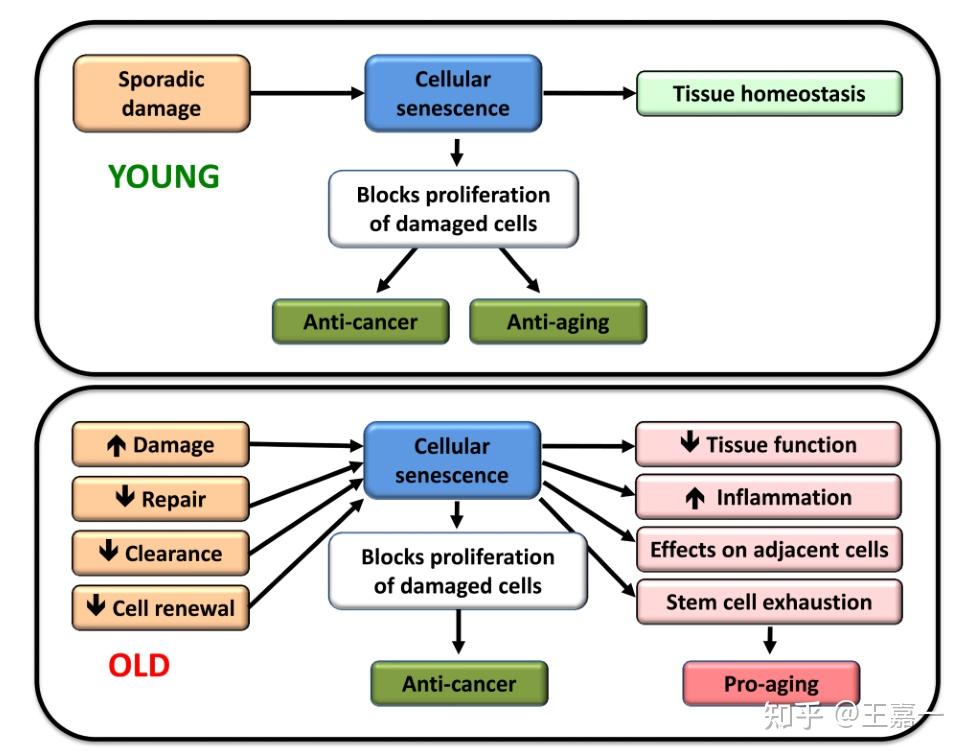
7. 细胞衰老
细胞衰老可以被定义为细胞周期的稳定停滞,伴随着刻板的表型变化。
8.干细胞耗竭
组织再生能力下降是衰老最明显的特征之一。例如,随着年龄的增长,造血功能下降,导致适应性免疫细胞的产生减少,这一过程被称为免疫衰老,并增加了贫血和髓系恶性肿瘤的发病率。在几乎所有成人干细胞隔室中都发现了类似的干细胞功能损耗。
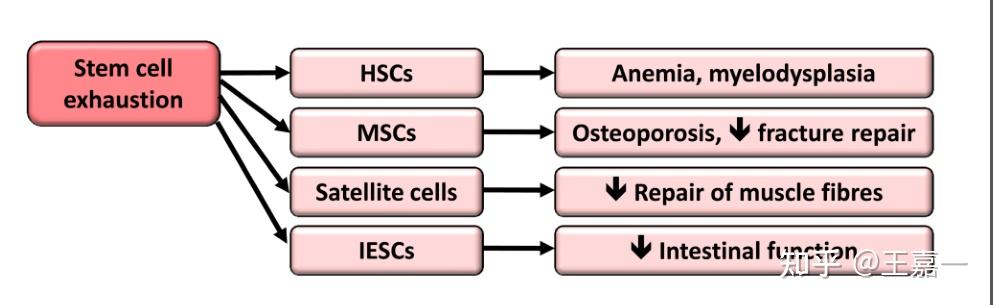
干细胞衰竭是多种衰老相关损害的综合结果,很可能是组织和组织衰老的罪魁祸首之一。最近研究表明,通过干细胞在生物水平上逆转衰老表型,返老还童成为一种可能
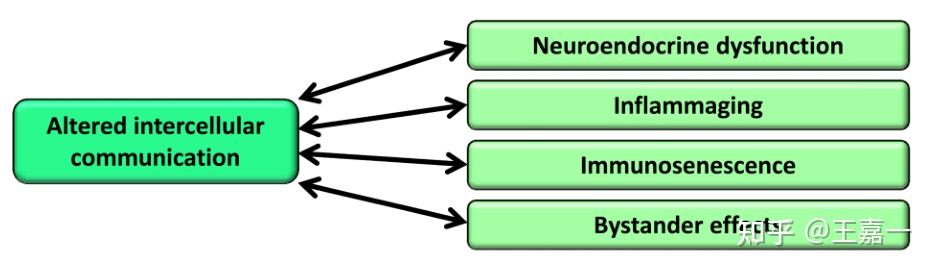
9. 细胞间通讯的改变
除了细胞自主改变,衰老还涉及细胞间通信水平的变化,无论是内分泌、神经内分泌还是神经元。
因此,随着炎症反应的增加,对病原体和癌前细胞的免疫监视减弱,细胞周围和细胞外环境的组成发生变化,神经激素信号(如肾素-血管紧张素、肾上腺素能、胰岛素-IGF1信号)在衰老过程中趋于失控,从而影响所有组织的机械和功能特性。
文献:C López-Otín, Blasco M A , Partridge L , et al. The Hallmarks of Aging[J]. Cell, 2013, 153(6):1194-1217.