gentle monster光学镜架怎么样?可以配近视镜片吗?
在哺乳动物大脑中任何地方对神经元进行成像的能力是光学显微镜的一个主要目标。在这里,我们描述了一种微创显微内窥镜系统,用于深入研究神经元的形态和功能。利用具有超薄壁的引导套管,我们展示了对小鼠大脑中深度埋藏的核团(如纹状体(深度2.5毫米)、黑质(深度4.4毫米)和外侧下丘脑(深度5.0毫米))进行的活体双光子荧光成像。我们首次报道了在头部固定的清醒小鼠的外侧下丘脑和黑质中观察到具有亚细胞分辨率的神经元活动。
一、 引言
荧光显微镜在亚细胞分辨率下监测神经元形态和活动的能力使其成为神经科学研究的有力工具。除了在少数高透明度的模式生物(如斑马鱼和秀丽隐杆线虫)中,光学显微镜由于组织中的光散射而局限于表面深度。使用现有的荧光报告基因,传统的双光子荧光显微镜无法对新皮层以下的神经元进行成像。为了到达大脑表面以下1毫米以外的结构,一种方法是移除覆盖感兴趣结构的组织。然而,这种方法仍然局限于较浅的皮层下结构,因为需要移除的组织体积与成像深度的三次方成正比。对于像外侧下丘脑这样距离小鼠大脑顶部5毫米的深层结构,需要移除的组织量(例如,使用0.8数值孔径的显微镜物镜,光锥覆盖111立方毫米或约20%的整个大脑体积)使得剩余组织无法在生理条件下被观察到。
另一种方法是结合梯度折射率(GRIN)透镜的显微内窥镜。GRIN透镜是具有近抛物线形径向折射率分布的微型棒状透镜。在光学上,GRIN透镜的行为类似于传统透镜。但由于其直径小于1毫米的微型尺寸,它可以嵌入大脑内部,在传统显微镜物镜和感兴趣的结构之间传递激发光和发射光。由于GRIN透镜所取代的组织体积与成像深度成线性关系,因此GRIN透镜特别适合于对深层埋藏的核团中的神经元进行成像。
GRIN透镜可以直接植入小鼠大脑中;然而,透镜成本高昂,手术过程的失败率也很高。因此,一种更具成本效益和时间效率的方法是植入引导套管,在成像过程中固定GRIN透镜。传统上,这些引导套管由薄壁玻璃管制成,一端用玻璃盖玻片密封,以允许光线进入组织。然而,这些玻璃管的壁厚显著增加了整体体积。例如,用于0.5毫米直径GRIN透镜的引导套管外径可能达到0.84毫米。结果,需要移除的总体组织体积是GRIN透镜单独占据体积的2.8倍。由于我们希望在对深层结构进行成像时尽可能少地移除覆盖组织,因此需要一种更优化的引导套管设计。
在本文中,我们描述了一种微创显微内窥镜系统,该系统使用0.5数值孔径(NA)、0.5毫米直径的GRIN透镜。我们设计了一种外径为0.61毫米的聚酰亚胺引导套管,与GRIN透镜体积相比仅增加了50%(例如,到达5毫米深度时,被取代的脑组织体积为1.5立方毫米,约占小鼠大脑总体积的0.3%)。我们将这种显微内窥镜系统与基因编码的钙指示剂结合使用,对头部固定的清醒小鼠的深层结构(如外侧下丘脑、纹状体和黑质)中的神经元和神经元活动进行长期成像。考虑到我们的显微内窥镜系统在制造、组装和操作方面的简便性,我们预计它将在深度神经回路的形态和功能解析中得到广泛应用。
二、 材料和方法
2.1 小鼠
所有实验方案均按照美国国立卫生研究院(NIH)的动物研究指南进行,并得到了霍华德·休斯医学研究所(Howard Hughes Medical Institute)珍妮莉亚研究园区(Janelia Research Campus)的机构动物护理和使用委员会(IACUC)的批准。实验使用了2至6个月大的雄性小鼠:C57BL/6J(用于外侧下丘脑成像)、Drd1a-cre(用于纹状体成像)和Gad2-cre(用于黑质成像)。
2.2 薄壁可长期植入引导套管的设计
为了减小整个显微内窥镜系统的尺寸,从而降低其侵入性,我们选择了薄壁聚酰亚胺管(壁厚:25微米)来组装引导套管(图1(a))。除了良好的热稳定性、机械强度和耐化学性外,聚酰亚胺已被证明与脑组织具有良好的兼容性。为了固定0.5毫米直径的GRIN透镜,我们选择了内径为0.56±0.006毫米、外径为0.61±0.012毫米、长度为8.4±0.005毫米(MicroLumen)的机械切割聚酰亚胺管作为套管主体。玻璃盖玻片(1号;厚度0.13 - 0.16毫米)被激光切割成直径为0.6±0.025毫米的圆盘(Laser Micromachining Limited)。激光切割过程使玻璃圆盘的横截面略呈梯形,锥角约为5 - 6度,这有助于通过紫外固化环氧树脂(Norland Optical Adhesive 68)将其与聚酰亚胺管的一端粘合。管子的另一端在实验期间保持开放,以便插入和移除GRIN透镜,并被一个端件包围,该端件提供了一个较大的表面积,以便用牙科水泥牢固地固定在颅骨上。引导套管的组装在内部进行或由Doric Lenses Incorporated完成。

东莞富临医疗科技有限公司是 Doric Lenses 亚洲代理商,为亚洲客户供应 Doric Lenses 电生理产品与配套产品。
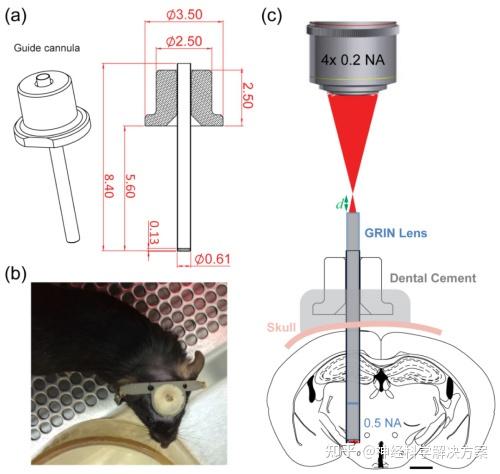
图1.微创显微内窥镜系统示意图。(a) 引导套管的设计。尺寸以毫米为单位。(b) 带有引导套管和头杆植入的小鼠。(c) 一个0.5毫米直径的GRIN透镜将0.2数值孔径物镜的焦点传递到深层埋藏核团(如外侧下丘脑)内的0.5数值孔径焦点。d表示物镜焦点与GRIN透镜顶部之间的距离。大脑、引导套管和GRIN透镜按比例绘制。比例尺:1毫米。
2.3 0.5数值孔径、0.5毫米直径GRIN透镜的特性
我们选择了一个双合GRIN透镜用于小鼠深层组织成像。由于直径为0.5毫米,该透镜可以轻松放入内径为0.56毫米的引导套管中。它在像侧的设计工作距离为100微米,在样品侧为250微米。透镜的总长度为9.86毫米,比引导套管长,因此便于插入和从套管中取出。它由两个GRIN单透镜组成,在物体(大脑)侧的数值孔径为0.5,在显微镜侧为0.19。激发激光在通往脑组织的途中形成的内部焦点位于透镜数值孔径为0.19的部分内部,从而避免了如果使用类似长度的0.5数值孔径单透镜可能发生的损伤和自发荧光背景。0.5的像数值孔径为神经元胞体的功能成像提供了足够的三维分辨率。
GRIN透镜被集成到一个配备有0.2数值孔径的4×空气物镜的双光子荧光显微镜中,该物镜产生的激发光初始焦点(0.2数值孔径,以匹配GRIN透镜像侧的0.19数值孔径)由GRIN透镜传递到样品侧(图1(c))。双光子荧光信号由GRIN透镜收集并传输回显微镜,并用光电倍增管检测。所有实验均使用调谐到900纳米的Ti:Sapphire飞秒振荡器作为激发光源。
由于GRIN透镜可能存在残余像差,我们测量了该GRIN透镜的轴向固有像差。在其设计像工作距离(即图1(c)中物镜焦点与GRIN透镜顶部之间的距离d为100微米)下,对于成像视野中心的1微米直径荧光珠,校正GRIN透镜的固有像差使信号加倍(图2(a)、2(b))。在自适应光学(AO)校正之前,珠子的横向和轴向图像的半高全宽(FWHM)分别为1.29微米和12.4微米。经过AO校正,横向和轴向FWHM分别为1.25微米和9.9微米,对应的横向和轴向分辨率分别为0.85微米和8.6微米。由于我们打算对神经元胞体进行成像,其尺寸远大于1微米直径的珠子,并且其双光子荧光信号对像差不太敏感,因此在后续实验中未使用自适应光学。
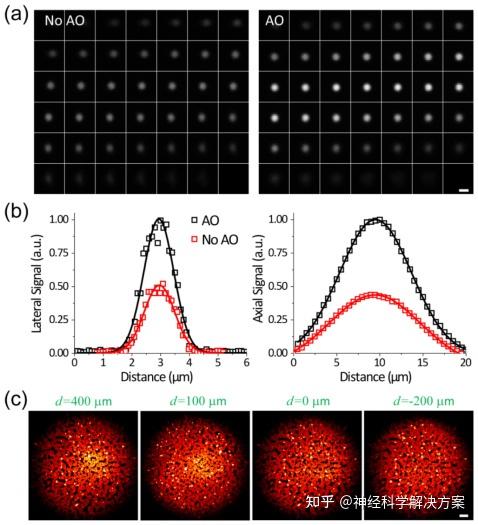
图2.0.5数值孔径、0.5毫米直径GRIN透镜的成像性能。(a) 1微米直径荧光珠在自适应光学(AO)校正前后的焦平面系列图像(步长0.5微米)。(b) (a)中焦平面系列图像在有和没有AO校正时测量的横向和轴向信号。(c)通过改变空气物镜焦点与GRIN透镜之间的像空间距离d,在不同焦平面上对大视场中的荧光珠成像。激发功率:15毫瓦。比例尺:(a)2微米;(c)20微米。
为了进行体内三维成像,我们在保持GRIN透镜与大脑相对位置不变的情况下改变了空气物镜与GRIN透镜之间的距离。通过将物镜焦点从GRIN透镜顶面上方400微米移动到下方200微米(图1(c)中的d从400微米变为 - 200微米),我们将样本侧的焦点从距离GRIN透镜底面160微米移动到340微米。我们基于GRIN透镜的显微内窥镜的成像视场(FOV)受离轴像差的限制。使用密集的微珠样本,我们发现不同工作距离下的视场大小没有显著变化,微珠成像于直径约为200微米的视场内(图2(c))。
2.4立体定位病毒递送和引导套管植入
小鼠用异氟烷麻醉后置于立体定位仪中。通过小切口暴露颅骨,并钻一个小孔(直径<1毫米)用于病毒注射和引导套管放置。首先将一根直径为500微米的斜口针插入大脑,然后拔出,从而为引导套管插入创建通道。将一根尖端直径为20 - 40微米的拉制玻璃吸管插入大脑,并注射AAV2/1 - Syn - GCaMP6s - WPRE - SV40(用于外侧下丘脑)或AAV2/1 - Syn - GCaMP6f - WPRE - SV40(用于纹状体和黑质)病毒,注射坐标为外侧下丘脑(前囟,–1.4毫米;中线,+0.85毫米;背侧表面,–5.3毫米和–5.0毫米;每个深度注射30纳升)、纹状体(前囟,+0.75毫米;中线,+1.5毫米;背侧表面,−2.5毫米)或黑质(前囟,−3.3毫米;中线,+1.4毫米;背侧表面:−4.4毫米)。使用微操作器将注射速度控制在30纳升/分钟。病毒注射后,使用适配立体定位仪的固定器(Doric Lens)将引导套管通过颅骨切开术插入到适当的目标深度。使用粘结剂将引导套管固定在颅骨上。然后在套管周围安装一个钛制或塑料制的头杆,以便在成像过程中对小鼠头部进行固定(图1(b)、1(c)),如先前所述。为防止小鼠破坏套管,套管的开口端要么用一片石蜡膜覆盖,然后用硅橡胶帽密封,要么用一个可重复使用的定制帽(Doric Lens)保护,该定制帽覆盖套管末端。在40只小鼠中,术后即时存活率为100%,其中一只小鼠在术后23天被实施安乐死。小鼠通常单独饲养6 - 8周,在此期间炎症反应减轻且病毒转导发生。
2.5体内成像与数据分析
在恢复和病毒转导期间,使用分级暴露技术使小鼠适应头部固定。简而言之,我们将逐渐呈现的引发焦虑的刺激(即头部限制)与对抗焦虑的反应(即甜食奖励)相匹配。将小鼠置于头部固定器中5分钟,从固定器中取出后立即给予甜食奖励。每天进行多次实验,头部固定时长逐渐增加到30 - 60分钟。
在成像之前,将处于麻醉或清醒状态的小鼠固定在头杆固定器上。取下硅橡胶帽(或Doric Lens设计的定制帽),然后将GRIN透镜放入引导套管中。随后用双光子荧光显微镜收集感兴趣结构的图像。在成像结束时,将GRIN透镜从引导套管中取出,并放置一个新的硅橡胶帽(或Doric Lens设计的定制帽),以防止碎屑落入引导套管。
使用ImageJ(1.47q版本)进行分析。对于钙成像图像堆栈,使用TurboReg插件进行图像配准,并从整个堆栈的平均图像中识别神经元胞体作为感兴趣区域(ROIs)。计算每个ROI在整个成像堆栈中的荧光强度,并据此计算相对荧光强度变化ΔF/F。
2.6组织学
小鼠用异氟烷深度麻醉,然后用生理盐水灌注,接着用磷酸盐缓冲盐水中的4%多聚甲醛(PFA)灌注处死。取出大脑,在4% PFA中固定过夜,然后转移到磷酸盐缓冲盐水中。用徕卡VT1200S振动切片机切取脑片(厚度:50微米),使用含DAPI的VECTASHIELD封片剂将脑片固定在载玻片上,然后加盖玻片用于成像。用宽场显微镜和共聚焦显微镜收集引导套管轨迹和神经元图像。为检查引导套管植入引起的炎症反应,在手术后2周和4周对小鼠进行灌注并切取脑片。如先前所述,对胶质标记物如离子化钙结合适配分子 - 1(IBA1)和胶质纤维酸性蛋白(GFAP)进行免疫染色。
三、 结果
3.1反应性神经胶质的免疫组织
化学分析表明长期植入的聚酰亚胺引导套管具有生物相容性诸如病毒注射或引导套管植入等侵入性手术会在大脑中引起炎症反应,在此期间神经元无法正常工作且成像质量较低。我们通过对植入后2周或4周采集的脑切片进行神经胶质标记物GFAP(胶质纤维酸性蛋白)和IBA1(离子化钙结合适配分子 - 1)的免疫染色,分析了组织对植入的聚酰亚胺引导套管的反应。植入后2周,反应性神经胶质在套管周围形成致密的鞘(图3(a))。然而,在植入后4周观察到炎症反应显著减少(图3(b))。我们通过计算有和没有引导套管插入的大脑半球中免疫化学反应性像素数量的比率来量化这种减少。对于GFAP,该比率从植入后2周的220倍降低到植入后4周的9倍;而对于IBA1,该比率从植入后2周的50倍降低到植入后4周的6倍。这些观察结果表明,由引导套管植入引发的炎症反应在大约4周的时间内基本消散。
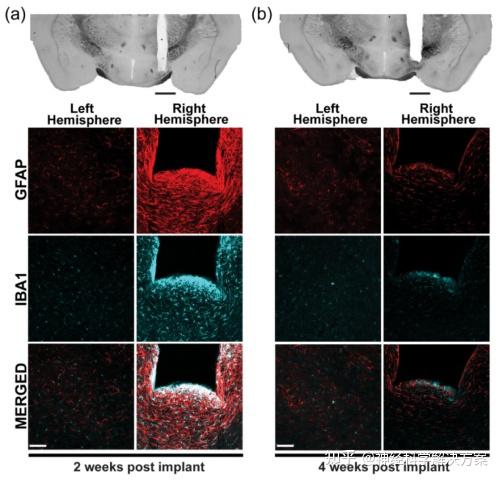
图3. 引导套管植入引发的炎症反应在大约4周后消散。(a)和(b) 上面板:脑切片的宽场图像,显示了下丘脑外侧上方右半球中植入的引导套管的位置。下面板:引导套管植入(a) 2周和(b) 4周后GFAP⁺和IBA1⁺神经胶质的共聚焦图像。来自左半球的图像作为完整脑组织中神经胶质群的对照。黑色比例尺:1毫米;白色比例尺:0.1毫米。
3.2清醒头部固定小鼠深部脑核神经元的慢性体内形态学成像
利用双光子荧光激发的光学切片能力,我们获得了体内深埋核(例如,表达GCaMP6s的下丘脑外侧神经元,见可视化1)中神经元的三维图像堆栈。在数值孔径为0.5时,内窥显微镜提供了足够的光功率来分辨亚细胞结构,如单个神经元突起(图4)。
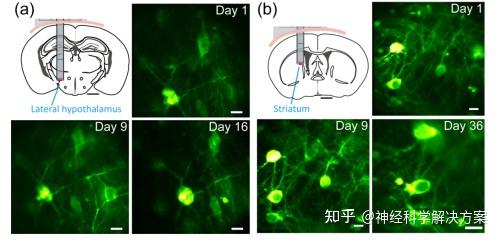
图4. 头部固定的清醒小鼠深埋核神经元的慢性体内图像。(a) 16天内下丘脑外侧神经元的双光子荧光内窥显微镜图像。(b) 36天内纹状体神经元的双光子荧光内窥显微镜图像。大脑、引导套管和GRIN透镜按比例绘制。黑色比例尺:1毫米;白色比例尺:20微米。
这些引导套管的长期稳定性和生物相容性使我们能够对下丘脑外侧(图4(a))和纹状体(图4(b))等深部脑核中的神经元进行数周的长期监测。在下丘脑外侧,我们在16天的时间跨度内观察到相同的神经元群;在纹状体中,相同的神经元被观察了36天(第36天的图像因显微镜下GRIN透镜的轻微倾斜而失真)。这表明我们的显微内窥镜系统为深部脑区神经元的体内成像提供了一个生理稳定的窗口。
3.3. 头部固定的清醒小鼠深部脑核神经元的体内功能成像
重要的是,我们系统的微创性还使我们能够对头部固定的清醒小鼠体内深部脑核的神经元活动进行监测(图5)。在小鼠下丘脑外侧(图5(a)),当小鼠处于麻醉状态时,神经元没有活动。一旦小鼠醒来,从表达钙指示剂GCaMP6s的神经元荧光强度变化计算得出的钙瞬变(ΔF/F)表明,在整个成像视场(FOV)内的神经元间观察到高度同步的活动(图5(b),见可视化2)。在黑质(图5(c)、5(d))中,神经元具有更多样化的活动模式,没有明显的同步性。尽管这些小鼠是清醒的,但几乎没有发现平面内或平面外的大脑运动,一些荧光特征(图5中标记为ROI 0的结构)的信号保持恒定,这表明观察到的荧光变化不是由大脑运动引起的,而是反映了这些神经元的神经元活动。
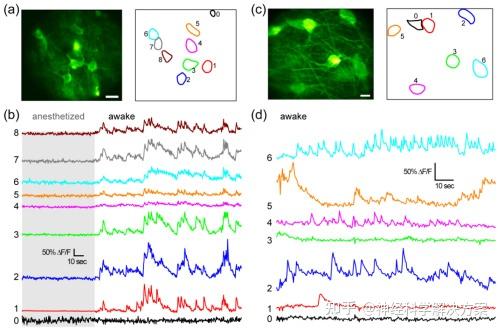
图5. 头部固定的清醒小鼠深埋核神经元活动的体内功能成像。(a) 左图:下丘脑外侧神经元的双光子荧光内窥显微镜图像;右图:感兴趣区域(ROIs)勾勒出单个神经元。(b) 通过(a)中神经元的钙瞬变ΔF/F测量的神经元活动,小鼠先被麻醉然后醒来。(c) 左图:黑质神经元的双光子荧光内窥显微镜图像;右图:ROIs勾勒出单个神经元。(d) 通过(c)中清醒小鼠神经元的钙瞬变ΔF/F测量的神经元活动。
四、结论
总之,我们设计了一种微创显微内窥镜系统,并将其应用于小鼠大脑深埋核的体内成像。我们设计了一种薄壁聚酰亚胺引导套管,在植入小鼠大脑时能将组织移除量降至最低,并且便于插入和取出直径为0.5毫米的GRIN透镜。它在植入后的数周乃至数月内具有生物相容性和结构稳定性,这使我们能够在不影响小鼠生存和健康的情况下对神经元的形态和功能特性进行长期体内监测。
通过我们的显微内窥镜系统利用双光子荧光激发,我们对深埋核中表达GCaMP6的单个神经元和神经元突起进行了成像。在头部固定的清醒小鼠的下丘脑外侧、纹状体和黑质中获取了具有极少运动伪影的高质量图像。还从这些神经元记录到了表明动作电位发放的钙瞬变。据我们所知,我们的结果首次展示了这些深埋结构中具有亚细胞分辨率的神经元活动。
相同的薄壁引导套管设计可应用于更大的GRIN透镜和/或动物(例如,大鼠、狨猴和猕猴)。尽管我们仅展示了我们的系统在双光子荧光成像方面的应用,但我们的系统与其他成像模式(如单光子宽场荧光成像)兼容。因此,我们期望我们的设计能被广泛采用,用于对深部大脑进行实验性探究。
东莞富临医疗科技有限公司是Doric Lenses在亚洲的代理商,为亚洲客户提供“技术服务”与“光电生理产品”
邮箱:li@fulinsujiao.com
公司地址:广东省东莞市樟木头镇塑金国际1号楼810
