一杯100 度的水可以把一杯0 度的水最多加热到多少度?63.21度是极限了吗?
这是一个非常棒的热力学问题。事实上,答案可能会令你震惊:我们可以经过一系列操作,最终把100℃的水降到0℃,而把0℃的水升温到100℃。
理论依据:用熵叙事
我们知道,对于孤立体系,讨论一个热力学过程能不能发生的根本判据是熵不能减少,也就是:
其中S代表体系的总熵。而对于 的过程,我们称之为可逆过程。当然,我们额外还有能量守恒的约束:
,U代表体系的总能量。
因此,对于题设中的孤立系统:A杯装有0℃的水,B杯装有等量100℃的水,假设我们用一些复杂的热力学装置将它们连接起来,然后考虑如下过程:
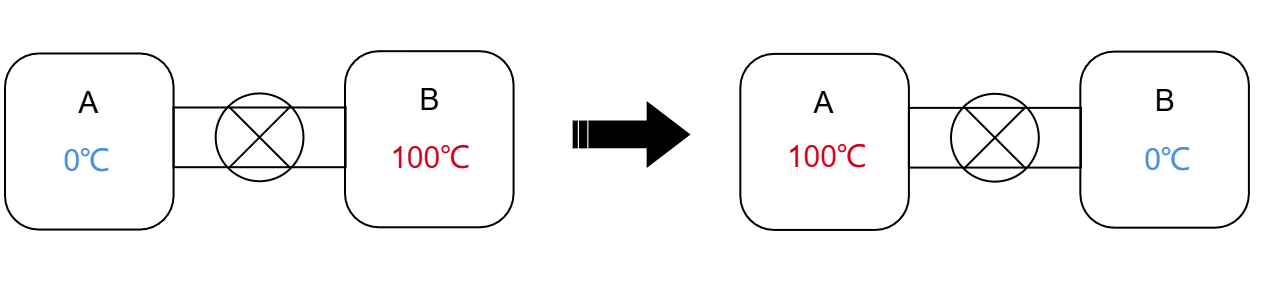
在这一过程中,如果内部装置的初始状态和终末状态完全相同,而我们知道A、B两杯水的热力学性质也完全相同,因此整个过程的初态和末态的熵也应该完全相同。 ,这样的过程在热力学上是允许的。
那为什么我们日常生活中,从来不会发生过这种反常的传热呢?答案也隐藏在熵中:如果我们直接把低温物体A和高温物体B接触,考虑A给B传递热量 (先假设这是一份很少的热量,因此忽略A和B的温度变化),则总的熵变为:
由于 ,因此当且仅当
时
。换句话说,只有A从B吸热的过程是热力学上允许的。因此直接接触会导致B不断传热给A,直到二者温度相同,整个过程的热量和熵变就是上述
和
的积分。可以得知这一过程
,熵增加了,是不可逆的。换句话说,此时如果我们想回到初始
的状态,或者达到A与B温度互换的状态,都是不可行的了——因为我们需要再构造
的步骤来让两步总的熵变等于0。
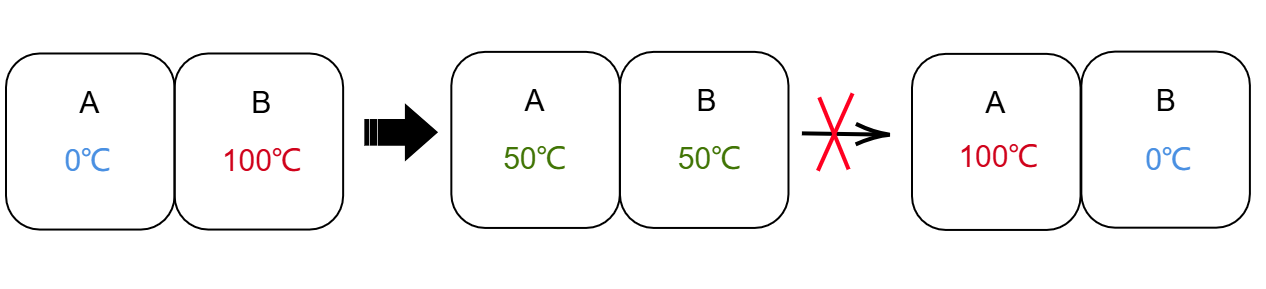
这也给了我们新的启发:想要达到温度互换的效果,必须要足够小心——要保持每一步操作都是 的可逆过程。
因此,仅靠传热是行不通的。因为两个物体间传热,能量守恒 要求:一个物体放出多少热量,另一个物体就要吸收多少热量。只要A、B温度不相等,上一个公式就揭示了这一步必然会导致熵增加。
为了破解这一局面,我们必须引入更灵活的热力学系统,来把能量以非热量的形式交换。例如理想气体,我们可以利用体积功:
还有电磁系统,我们可以利用电功、磁矩和磁场交互的功等等。事实上,一个“夹杂了做功私货的可逆传热”就是大名鼎鼎的卡诺热机。
物理构造:卡诺热机
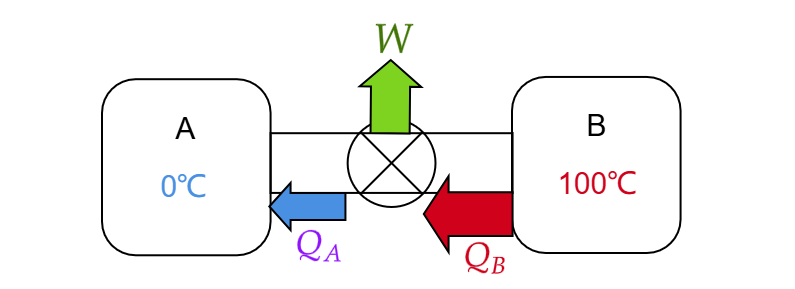
卡诺热机干的事情就是:高温热源吸热,低温热源放热,热量差以做功的形式放出。整个过程完全可逆地进行,即 。能量交换关系如下:
实现这一过程的热力学装置很多,例如我们上节提到的理想气体就可以构造卡诺循环:
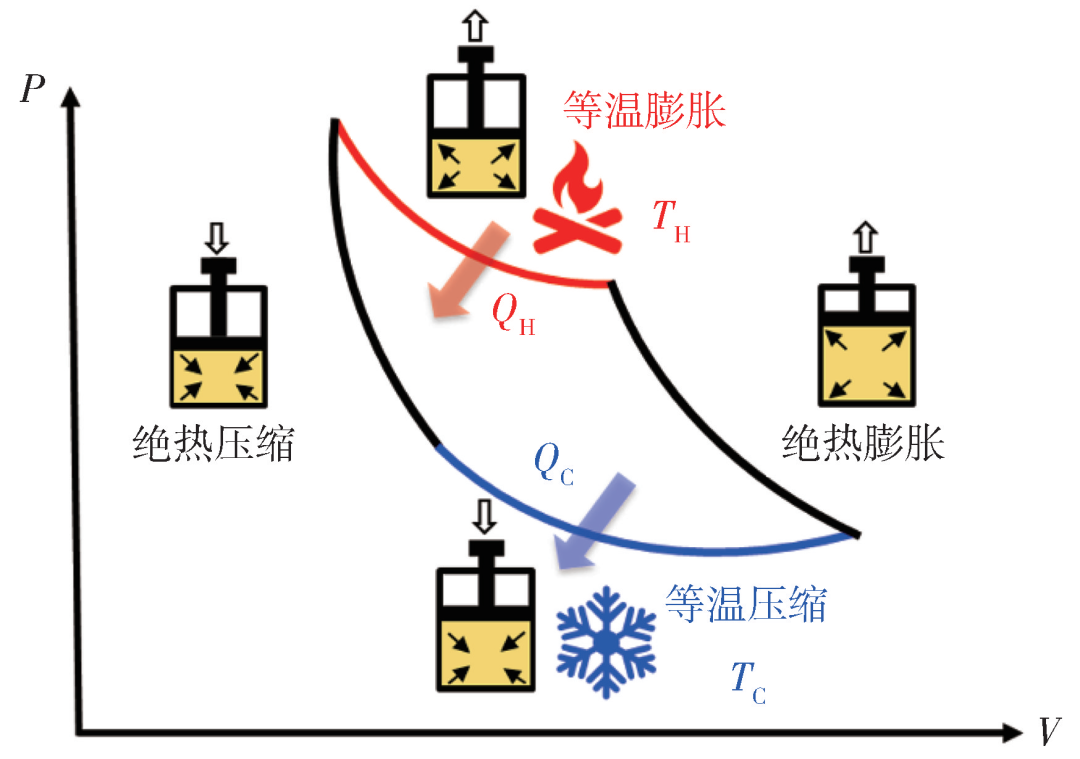
循环一次的过程完美符合前述对卡诺热机的描述。还要注意:卡诺循环运行始末,热机的内部状态是复原的。这保证了整个过程不只是熵意义下的可逆,还是操作意义下的可逆:卡诺热机是可以倒着开的,你可以输入功以从低温热源吸热,并放热给高温热源。
相信聪明的读者已经get到怎么实现本文开头提出的目标了:
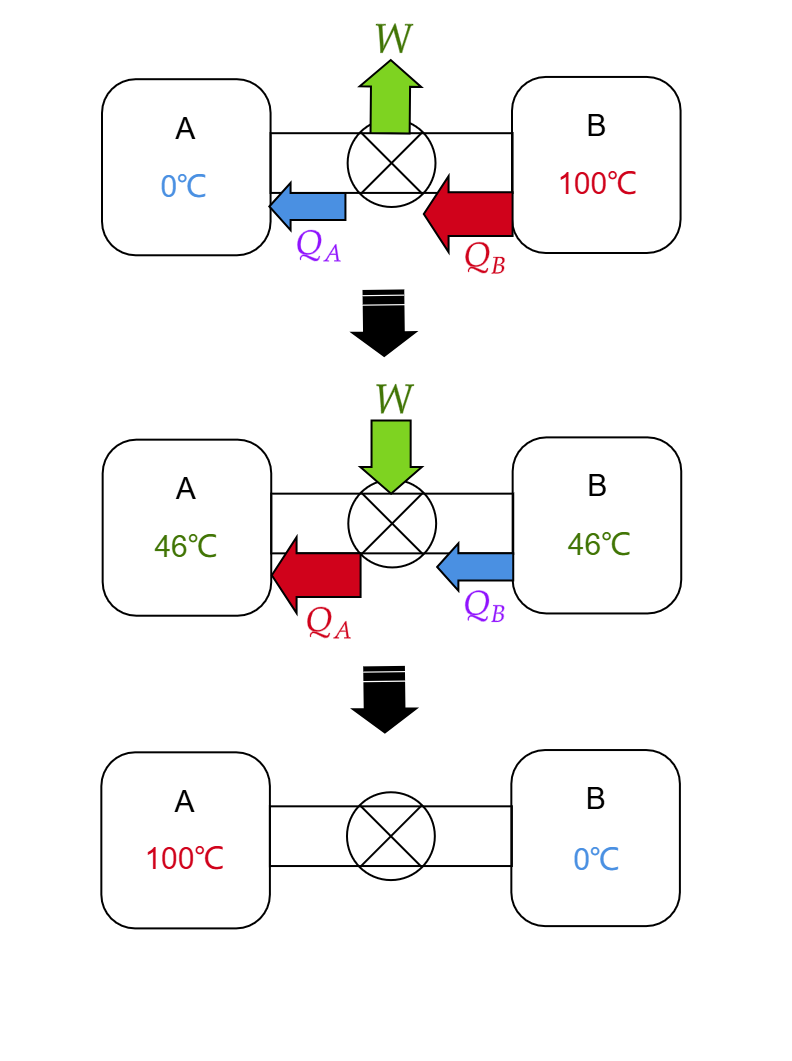
先用卡诺热机把A与B的温度拉平,然后再倒开卡诺热机(此时A和B扮演的角色互换),用刚才产出的功把热量泵到A中去。
当然其中涉及到一个存储功的问题,可以用可逆电池之类的东西来实现,或者用一些力学装置。总之,整个过程在理论上是完全可行的。我们从0℃的A和100℃的B出发,利用卡诺热机,得到了100℃的A和0℃的B,且热机装置的始末状态完全相同。