什么叫做活化能?什么叫做化学反应活跃状态?
发布时间:
2025-02-27 00:58
阅读量:
17
先说结论:活化能是化学反应的门票,活跃状态是反应物在「逃票翻墙」时最危险的姿势!
一、活化能:化学反应界的「入场费」
想象你要翻越一堵墙(完成反应),但口袋里没钱买门票(缺乏能量)。这时候你发现墙上有铁丝网(活化能),必须助跑冲刺到某个高度才能翻过去。
科学版定义:
活化能(Ea)= 反应物分子要「搞事情」必须达到的 最低能量门槛,等于过渡态能量与反应物平均能量的差值。
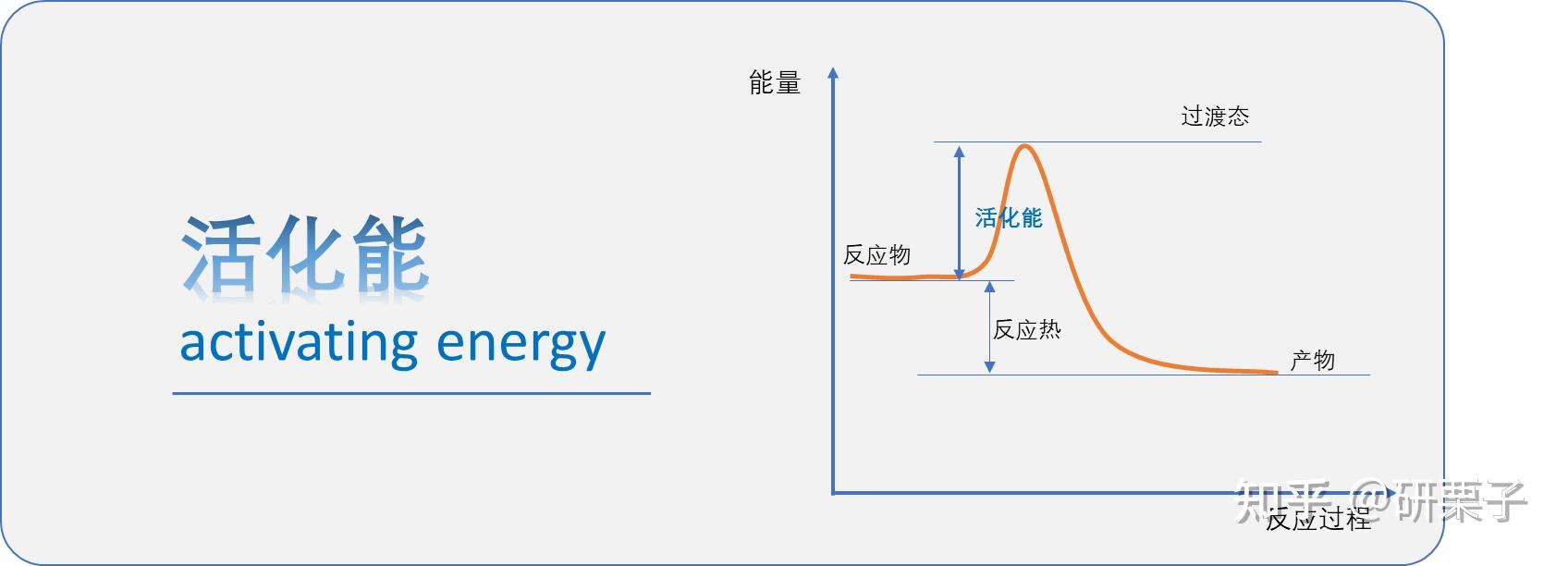
二、活跃状态:分子界的「走钢丝时刻」
当反应物分子获得足够活化能后,会进入一个状态:
旧化学键将断未断
新化学键将成未成
所有原子处于能量最高点
这个瞬间的分子构型叫做 过渡态(Transition State),也就是问题中的「活跃状态」。
举个栗子:
CO₂想和H₂O牵手生成H₂CO₃(碳酸),必须经历「一手拽氧气,一手拉水分子」的扭曲姿势,这个瞬间就是活跃状态。
注:
1. 过渡态≠中间体:前者存在时间仅10^-13秒(光走一根头发丝的时间),后者是能被仪器检测的稳定存在
2. 催化剂骚操作:不是降低反应热,而是给反应修了条「高速公路隧道」(降低活化能)
3. 温度玄学:升温10℃能让反应速率翻倍,本质是更多分子「有钱买票」翻越活化能壁垒
END