诺贝尔化学奖授予蛋白质设计算法和 AI 结构预测,诺奖为何连续两天颁给 AI?化学的尽头是计算机吗?
知道他会得奖,没想到这么快就得奖了。
昨天还在预测说生物里的二代测序和蛋白质结构预测可能是大热门:

AlphaFold问世至今已经三年,带动起来了还包括多款AI蛋白质结构预测的软件,想要解决的问题恰恰就是二代测序产生的海量序列,大家无法解析其中蛋白质功能的难题。
为什么AI预测蛋白质结构如此重要呢?
这一点在AlphaFold横空出世的那一刻就已经决定了,我们不妨来唠唠这个才过去没几年的故事吧~
过去的几十年里,世界各地的顶尖结构生物学家完成了大约18万种蛋白质结构的解析;但在发布的两年里,AlphaFold 完成了人体内几乎所有蛋白质的结构预测。
看回这项诺贝尔奖,你脑袋上一定有很多问号:什么是蛋白质?它的结构很复杂吗?为什么要用人工智能来预测蛋白质结构?
说起蛋白质,相信不少人其实并不陌生,甚至了解蛋白质是细胞里行使各种功能的“元件”。不仅如此,蛋白质也是组成我们身体的基本物质之一。比如说健身可以锻炼肌肉,但想要肌肉增强变大,就必须有足够的蛋白质供给才行。
餐桌上的鸡蛋、牛奶以及各种肉类都是富含蛋白质的食物,对于人类来说,蛋白质唾手可得;但是,想要得到蛋白质的结构却难于上青天。

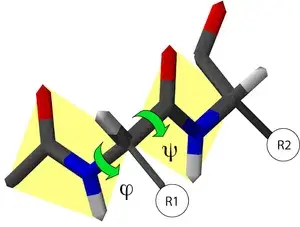
因为蛋白质的结构非常复杂:简单讲,氨基酸组成蛋白质,一个个氨基酸会有叫肽键的结构链接,它的连接可以形成两种不同的角度。
那现在给大家出一个简单数学题:假设有100个氨基酸组成蛋白质,那就需要99个肽键,99个肽键有两种不同角度的结构,同时不同角度还会有三种可能的稳定结构,那就是3的198次方种可能,你要是慢慢穷举,从宇宙爆炸到现在都数不完,这就是利文索尔悖论——蛋白质结构非常非常多样,没办法用穷举来算完。
结构这么复杂该怎么办?生物学家最直接的想法就是观测,用不同的方法来测量:上世纪五六十年代,用的是X光衍射——把蛋白质结晶,然后打上X光,通过反射的角度可以推测蛋白质长什么样子,这个难点就是怎么把蛋白质纯化结晶出来。
另一个现在很热门的研究方法叫冷冻电镜,就是利用冷冻切片技术,加上电子显微镜直接看蛋白质结构,但缺点就是非常非常贵,太烧钱了。
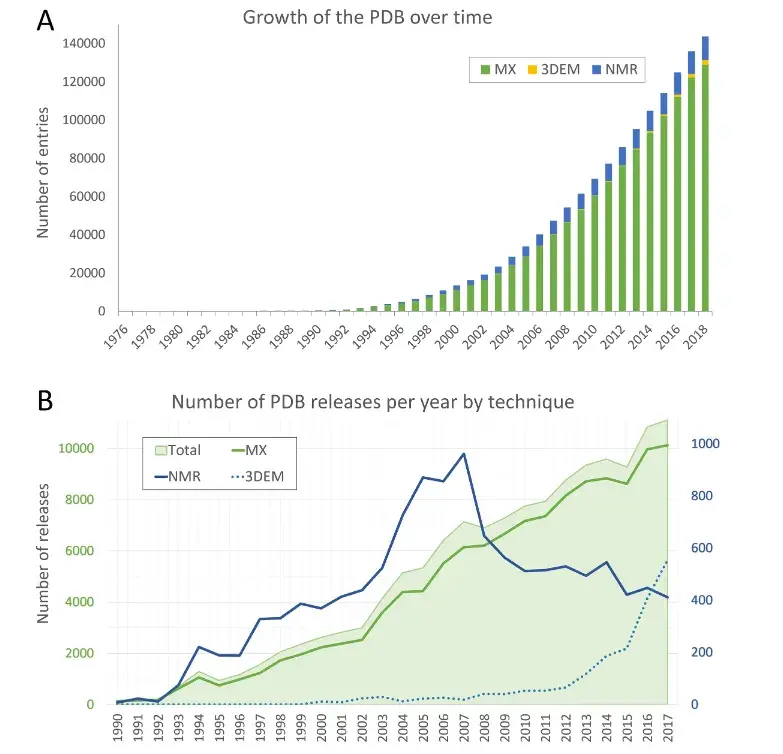
那大家猜猜这么些方法,测量了几十年了,我们分析出来多少个蛋白质结构?其实已经不少了,根据数据库记载,现在实验已经解析了18万种蛋白质。
但是相对的,我们刚刚说到蛋白质是氨基酸组成的,只要测序技术测得到DNA序列,就能推导出蛋白质序列。查找数据库可以发现,现在已知的有十几亿种蛋白质序列,这和18万之间差了将近一万倍。
所以结构生物学家就很苦恼——测序太简单了,导致结构生物学远远跟不上测序的速度。
.
所以很多开发算法的计算生物学家就想预测结构,通过算法预测肯定比做实验快很多。但是刚刚也说了利文索尔悖论,预测结构非常非常难,你要是穷举那是天文数字。
所以有很多的计算思路,比如我可以类比,实验解出来的结构我可以类比相似的序列,推测相似的序列会不会有相似的结构,这个叫同源建模;也可以拆开来类比,比完再像缝缝补补拼积木一样把结构拼出来,这个叫穿线法……但是这么多方法都有个问题:精度特别差。这就好像我想看1080P的高清视频,但是怎么调都只有马赛克高糊版,看都看不清。
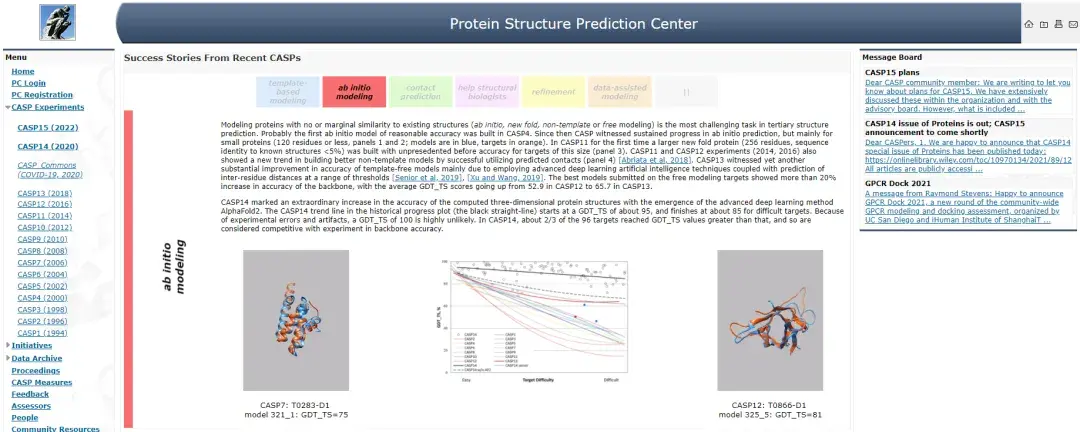
为了促进各国科学家不断向前,从1994年开始,每两年都会举办CASP,叫蛋白质结构预测关键测试,来评估大家的算法预测准不准,来提高算法的精度。
简单来说就是从各种蛋白质序列里挑几个出来,一边让结构生物学家做实验解出一个“标准答案”,然后计算生物学家就用自己的算法来比,看看谁跟标准答案更接近。
但很遗憾,24年过去了,仍然进展很慢。
直到2018年,一个叫AlphaFold的方法出来,得到了80分的高分,两年之后2020年AlphaFold二代打分到了90分,基本就和实验做出来的标准答案一样了。还是刚刚1080P的比喻的话,别人预测像个马赛克,但AlphaFold2预测就已经差不多1000P,和1080P基本大差不差。
这个大家也知道了,就是Deepmind公司开发的人工智能方法。
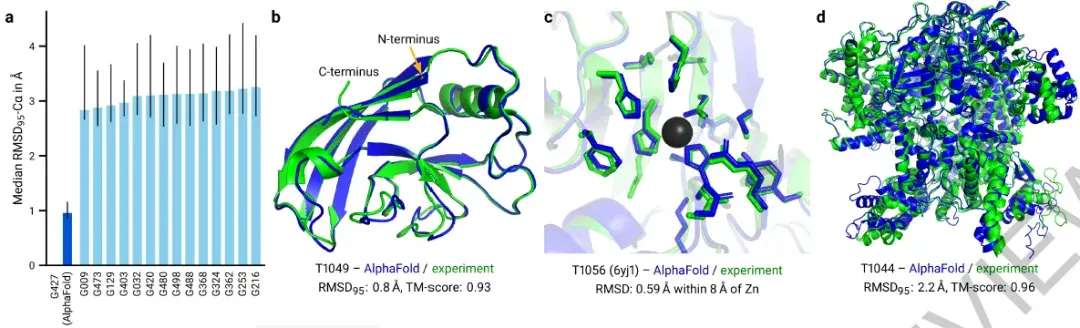
随后这个算法实际应用到了生物学上,一发不可收拾。
一是Deepmind开发的AlphaFold2算法,在短短几个月时间里,就把几十年结构生物学家解析的没解析完的蛋白质都解了:人体98%的蛋白质都试着预测了一遍,其中三分之一能准确预测,还有一些也能大概预测一半多。同时他们声称后面几个月就把数据库扩展到一亿个蛋白质。这就比实验方法快了上万倍了。
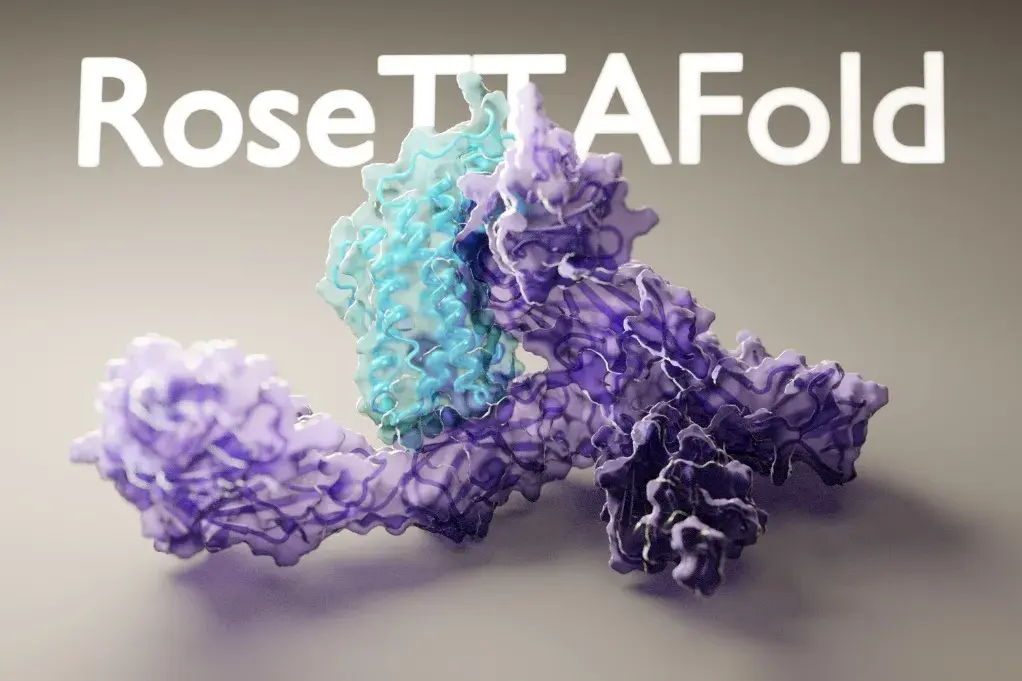
另一个生物学上的应用,是同样基于人工智能算法开发的RoseTTAFold,它挑战的是更难的领域——怎么预测蛋白质和蛋白质相互结合,也在短时间预测了几千种蛋白质的相互结合。
在AlphaFold2正式发布后只过了半年多,2022年7月,DeepMind公司的CEO,德米斯·哈萨比斯就在新闻发布会宣布:我们已经掌握了“整个蛋白质世界”(The entire protein universe)——AlphaFold马不停蹄地运转,成功完成了现有蛋白质数据库中全部2.14亿种蛋白质的结构预测。

2.14亿种蛋白质中,有35%被评估为高度准确,虽然这个数字看起来不高,但是按照目前实验检测的水平,全部做完也就差不多这个水平——更何况,截至目前实验检测花了几十年也只测出了14万种。
仅在DeepMind公司宣布完成了“整个蛋白质世界”三个月后,2022年10月,Meta公司(原名Facebook)就拓宽了这个“蛋白质世界”的边界(‘dark matter’ of the protein universe)——他们利用自己开发的大型语言模型算法ESMFold,预测了6.17亿种来自宏基因组信息的微生物蛋白质结构。
ESMFold算法的准确度虽然略逊于AlphaFold,但它的优势在于能以60倍于AlphaFold的速度去预测短序列蛋白质的结构,这就使得它在预测结构相对简单的微生物蛋白质上有了很大的优势。
没过几天,AI又开始颠覆生物学家的认知了——创造蛋白质。
这其实是一个和蛋白质结构预测刚好相反的问题:蛋白质结构预测是从序列到结构,而创造蛋白质是要求从我们希望得到的结构,反推出合适的蛋白质序列。过去这是个计算量巨大的工作,现在AI也能完成了。
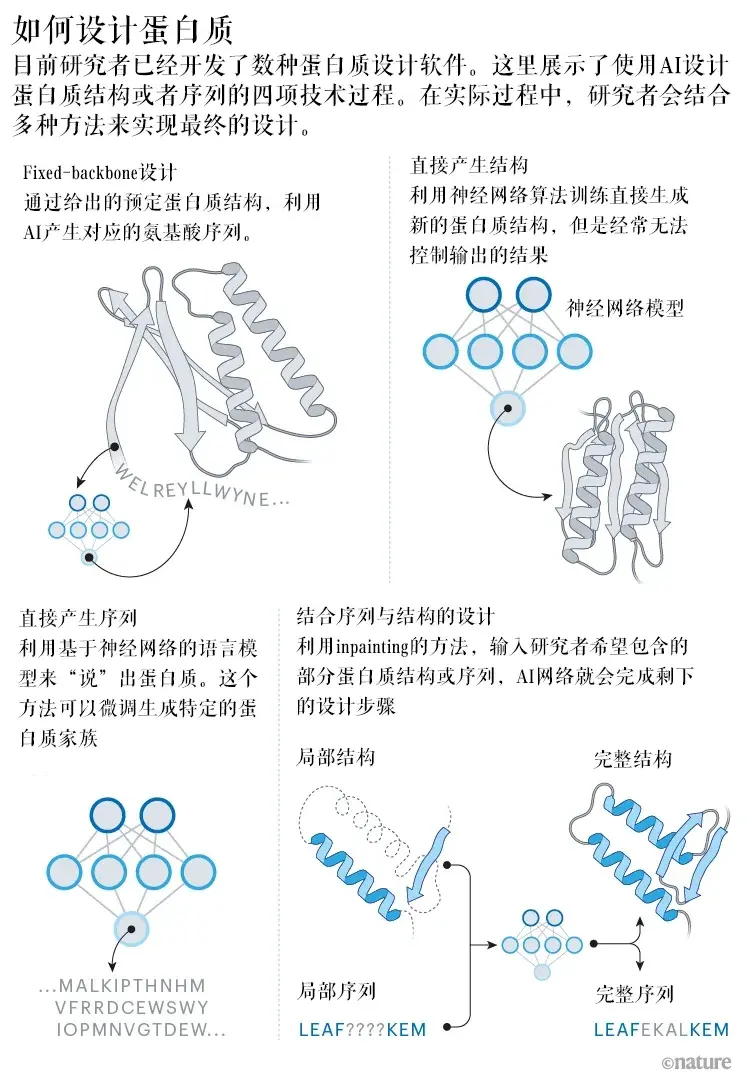
相比于大批量预测蛋白质结构,创造蛋白质的目的就更加明确——我们希望能创造出自然界不存在,但是对人类非常有用的蛋白质。
设计蛋白质的尝试还在不断进步和迭代,已经逐渐用到了实际应用当中。例如在RoseTTAFold的研究中,利用ProteinMPNN和RoseTTAFold方法设计出来的蛋白质,不仅在自然界完全不存在,并且大大提高了这些蛋白质结构的稳定性,预计在未来会被用作疾病治疗的抗原抗体,或者生物化学反应所需的生物酶。
不少人可能要问了:预测蛋白质结构,到设计蛋白质,有啥用呢?
我们最开始就提到了蛋白质在我们生活无处不在,而蛋白质要发挥功能,基础是要有一定的结构。所以预测蛋白质结构,可以帮助我们更好地理解蛋白质的功能,进而去比如构建蛋白质分子药物,或者研究复杂的生物化学现象。
一个最简单的例子,比如现在我们知道新型冠状病毒的新变异奥密克戎传播力特别强,而这传播关键的刺突蛋白结构,就可以利用人工智能来预测,进而可以推测什么药物或者治疗方法可以更有效的针对奥密克戎。
但同时,虽然说人工智能已经完成了结构生物学家很多的工作,但是这个预测仍然是不完善的:
比如有些复杂的结构,可能结构生物学家实验还没有解析出来,人工智能也就还没办法学习到,因此也预测不出来,所以很多问题仍然需要结构生物学家的深入探究;
还有很多蛋白在发挥功能的时候是一个动态变化的过程,这种时候预测的结果就不准确,还是用1080P举例的话,就是理论上是一个1080P的视频,但是人工智能在这几秒预测出来是1080P高清,那几秒预测出来却是马赛克,所以也不准确。
这些都是人工智能预测蛋白质的瑕疵,但是瑕不掩瑜,人工智能在蛋白质结构预测带给我们的惊喜实在太多了,而这项诺贝尔奖,就是计算科学在生命科学上最好的应用。